Malikata acido
| Ne konfuzu ĉi tiun artikolon kun maleata acido. |
| Malikata acido | ||
 | ||
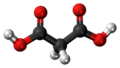
| Plata kemia strukturo de la Malikata acido | ||
 | ||
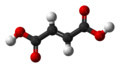
| Tridimensia kemia strukturo de la Malikata acido | ||
| Alternativa(j) nomo(j) | ||
| ||
| Kemia formulo | ||
| CAS-numero-kodo | 6915-15-7 | |
| ChemSpider kodo | 510 | |
| PubChem-kodo | 525 | |
| Merck Index | 15,5771 | |
| Fizikaj proprecoj | ||
| Aspekto | blankaj kristaloj | |
| Molmaso | 134.087 g·mol−1 | |
| Denseco | 1.609g cm−3 | |
| Fandpunkto | 130 °C | |
| Ekflama temperaturo | 203 °C | |
| Acideco (pKa) | 5.20 | |
| Solvebleco | Akvo:558 g/L | |
| Mortiga dozo (LD50) | 1600 mg/kg (buŝe) | |
| Sekurecaj Indikoj | ||
| Riskoj | R22 R37/38 R41 R42/43 R34 [1] | |
| Sekureco | S26 S39 | |
| Pridanĝeraj indikoj | ||
| Danĝero
| ||
| GHS etikedigo de kemiaĵoj | ||
| GHS Damaĝo-piktogramo |
| |
| GHS Signalvorto | Averto | |
| GHS Deklaroj pri damaĝoj | H302, H315, H319, H335[2] | |
| GHS Deklaroj pri antaŭgardoj | P261, P264, P270, P271, P280, P301+312, P302+352, P304+340, P305+351+338, P312, P321, P330, P332+313, P337+313, P362, P403+233, P405, P501 | |
(25 °C kaj 100 kPa) | ||
Malikata acido aŭ malata acido[3] aŭ pomacido (C4H6O5) estas acidet-gusta, organika dikarbona acido, kiu troviĝas en multaj acidaj manĝaĵoj. Ĝi formas senkolorajn kristalojn, ĝi estas higroskopa. Ĝi bone solviĝas en akvo kaj alkoholo. Ĝi estas hidroksi-derivaĵo de la Sukcenata acido. Ĝin izolis unuafoje Scheele el nematura suko de groso, en 1785.
Ĝia anjona formo, la malato estas – simile al fumarato- la intermaterialo de la citra ciklo. Ĝi povas estiĝi el piruvato per anaplerotika reakcio.
Optika izomerio
[redakti | redakti fonton]La biologiaj pomaj acidoj estas homoĥiralaj kaj aperas en la naturo en formo de (−)-pomacida enantiomero.
Kemiaj proprecoj
[redakti | redakti fonton]La pomacido montras la ĝeneralajn karakterizaĵojn de la hidroksikarbonaj acidoj. Ĝin karakterizas reakcioj de la hidroksila grupo kaj same tie de karboksila grupo. Ĝi kondutas kiel duvalora acido, ekzistas ties normalaj kaj acidaj saloj. La salo de la pomkacido nomiĝas malato post ties latina nomo.
La pomacido transformiĝas en 160 °C – kun akvoperdo – al Fumarata acido kaj Maleata anhidrido. Tiu reakcio povas okazi inverse. La malikata acido kaj la fumarata acido – sub premo kaj en ĉeesto de akvo kaj alkaloj aŭ metalsaloj- transformiĝas dum aro al racema miksaĵo de pomacido, al DL-pomacido. La anstataŭigo de la pomacida hidroksila grupo per halogeno okazas per inversio, t.n. Walden-inversio.
La sekundara alkohola hidroksila grupo de la pomacido estas transformebla per malforta oksidado (ekz. per KMnO4) al ketono-grupo kaj tiam estiĝas oksalvinagra acido. Tiu reakcio estas returnebla, tiam la oksalvinagra acido reduktiĝas al pomacido.
Troviĝejo
[redakti | redakti fonton]La pomacido estas la plej ofta el la plantaj acidoj, ĉefe en fruktoj kiel verda pomo, acida ĉerizo, pruno, sed en folio de tabako, rebarbaro, en suko de kelkaj lignoj (betulo, frakseno).
Produktado
[redakti | redakti fonton]Oni produktas la pomacidon el fumarata acido per mikrobiologia metodo. ĝi estas ankaŭ produktebla per hidrolizo de la Klorosukcenata acido (CAS-numero 16045-92-4), sed tiu sintezo pli gravas el teoria vidpunkto (Walden-inversio).
Uzeblecoj
[redakti | redakti fonton]Oni uzas la pomacidon kiel aldonaĵon en la nutraĵa industrio, kie ĝi havas la numeron E296 (E-numero).